Page 47 - พันธะเคมี
P. 47
47
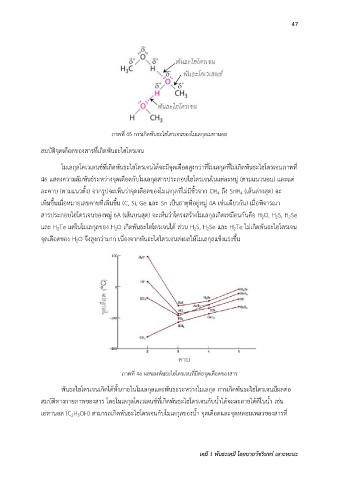
ภาพที่ 45 การเกิดพันธะไฮโดรเจนของโมเลกุลเมทานอล
สมบัติจุดเดือดของสารที่เกิดพนธะไฮโดรเจน
ั
โมเลกุลโคเวเลนซ์ที่เกิดพันธะไฮโดรเจนได้จะมีจุดเดือดสูงกว่าที่โมเลกุลที่ไม่เกิดพันธะไฮโดรเจนภาพที่
46 แสดงความสัมพันธ์ระหว่างจุดเดือดกับโมเลกุลสารประกอบไฮโดรเจนในแต่ละหมู่ (ตามแนวนอน) และแต่
ละคาบ (ตามแนวตั้ง) จากรูปจะเห็นว่าจุดเดือดของโมเลกุลที่ไม่มีขั้วจาก CH ถึง SnH (เส้นล่างสุด) จะ
4
4
ิ่
เพิ่มขึ้นเมื่อหมายเลขคาบที่เพมขึ้น (C, Si, Ge และ Sn เป็นธาตุที่อยู่หมู่ 4A เช่นเดียวกัน) เมื่อพิจารณา
สารประกอบไฮโดรเจนของหมู่ 6A (เส้นบนสุด) จะเห็นว่าโครงสร้างโมเลกุลเกิดเหมือนกันคือ H O, H S, H Se
2
2
2
และ H Te แต่ในโมเลกุลของ H O เกิดพันธะไฮโดรเจนได้ ส่วน H S, H Se และ H Te ไม่เกิดพันธะไฮโดรเจน
2
2
2
2
2
จุดเดือดของ H O จึงสูงกว่ามาก เนื่องจากพันธะไฮโดรเจนส่งผลให้โมเลกุลแข็งแรงขึ้น
2
ภาพที่ 46 ผลของพันธะไฮโดรเจนที่มีต่อจุดเดือดของสาร
พันธะไฮโดรเจนเกิดได้ทั้งภายในโมเลกุลและพันธะระหว่างโมเลกุล การเกิดพันธะไฮโดรเจนมีผลต่อ
สมบัติทางกายภาพของสาร โดยโมเลกุลโคเวเลนซ์ที่เกิดพันธะไฮโดรเจนกับน้ าได้จะละลายได้ดีในน้ า เช่น
เอทานอล (C H OH) สามารถเกิดพันธะไฮโดรเจนกับโมเลกุลของน้ า จุดเดือดและจุดหลอมเหลวของสารที่
2 5
เคมี 1 พันธะเคมี โดยนายวัชรินทร์ เลาะหะนะ