Page 129 - Nilam_Publication_module_Chemistry_Form.pdf
P. 129
Chemistry Form 4 • MODULE
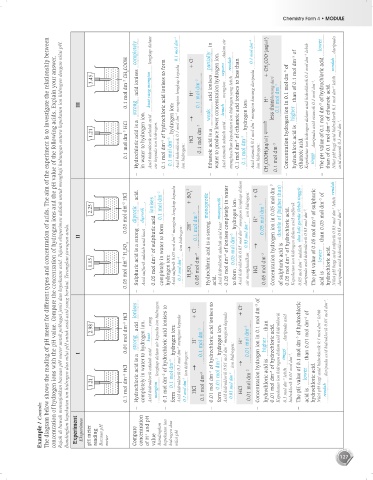
The diagram below shows the reading of pH meter for different types and concentration of acids. The aim of the experiment is to investigate the relationship between
in lower daripada
Rajah di bawah menunjukkan bacaan pH meter untuk pelbagai jenis dan kepekatan asid. Tujuan eksperimen adalah untuk mengkaji hubungan antara kepekatan ion hidrogen dengan nilai pH.
completely lengkap dalam 0.1 mol dm –3 partially dalam air rendah . 0.1 mol dm –3 rendah
concentration of hydrogen ions with the pH value. Compare the concentration of hydrogen ions and the pH value of the following acids. Explain your answer.
0.1 mol dm –3 CH 3 COOH acid ionises kuat yang mengion H + + Cl – 0.1 mol dm –3 acid ionises mengion
3.45 separa H + + CH 3 COO – (aq/ak) than of 0.1 mol dm –3 of
III strong 0.1 mol dm –3 of hydrochloric acid ionises to form Asid hidroklorik 0.1 mol dm –3 mengion lengkap kepada weak water to produce lower concentration hydrogen ion. lemah 0.1 mol dm –3 of ethanoic acid ionises to less than hydrogen ion: Asid etanoik 0.1 mol dm –3 mengion kurang daripada less than/kurang dari 0.1 mol dm –3 Concentration hydrogen ion in 0.1 mol dm –3 of higher Kepekatan ion hidrogen dalam asid hidroklorik 0.1 mol dm –3 lebih
0.1 mol dm –3 HCl Hydrochloric acid is a in water to hydrogen ion. Asid hidroklorik adalah asid air kepada ion hidrogen. ion hidrogen: HCl Ethanoic acid is a Asid etanoik adalah asid 0.1 mol dm –3 ion hidrogen: CH 3 COOH(aq/ak) 0.1 mol dm –3 hydrochloric acid is ethanoic acid. asid etanoik 0.1 mol dm –3 .
1.21 0.1 mol dm –3 hydrogen ion: 0.1 mol dm –3 menghasilkan kepekatan ion hidrogen yang lebih than of 0.1 mol dm –3 of ethanoic acid. Nilai pH bagi asid hidroklorik 0.1 mol dm –3 lebih
tinggi
– – – – – –
2–
0.05 mol dm –3 HCl diprotic diprotik 2H + + SO 4 H + + Cl – 0.05 mol dm –3 dua kali ganda (lebih tinggi) than 0.05 mol dm –3 of
2.25 acid. . ionises 0.1 mol dm –3 monoprotic monoprotik . ion hidrogen: double of (higher than)
Bandingkan kepekatan ion hidrogen dan nilai pH untuk asid-asid yang berikut. Terangkan jawapan anda.
II Asid sulfurik 0.05 mol dm –3 mengion lengkap kepada ion hidrogen: 0.1 mol dm –3 0.05 mol dm –3 of ionises completely in water 0.05 mol dm –3 hydrogen ion: Asid hidroklorik 0.05 mol dm –3 mengion lengkap dalam 0.05 mol dm –3 Concentration hydrogen ion in 0.05 mol dm –3 0.05 mol dm –3 of hydrochloric acid. Kepekatan ion hidrogen dalam asid sulfurik daripada asid hidroklorik 0.05 mol dm –3 . The pH value of 0.05 mol dm –3 of sulphur
0.05 mol dm –3 H 2 SO 4 hydrogen ion: 0.1 mol dm –3 H 2 SO 4 0.05 mol dm –3 to form air menghasilkan HCl 0.05 mol dm –3 adalah acid is hydrochloric acid.
1.15 Sulphuric acid is a strong Asid sulfurik adalah asid kuat 0.05 mol dm -3 of sulphuric acid completely in water to form Hydrochloric acid is a strong Asid hidroklorik adalah asid kuat 0.05 mol dm –3 of sulphuric acid is lower
acid.
– – – – – –
ionises
0.01 mol dm –3 HCl strong kuat lengkap dalam air kepada ion hidrogen. H + + Cl – 0.1 mol dm –3 H + + Cl – 0.01 mol dm –3 than 0.01 mol dm –3 of daripada asid hidroklorik 0.01 mol dm –3 .
2.98 acid yang than daripada asid
I completely in water to hydrogen ion. 0.1 mol dm –3 of hydrochloric acid ionises to 0.1 mol dm –3 hydrogen ion: Asid hidroklorik 0.1 mol dm –3 mengion kepada 0.01 mol dm –3 of hydrochloric acid ionises to form 0.01 mol dm –3 hydrogen ion: Asid hidroklorik 0.01 mol dm –3 mengion kepada ion hidrogen: Concentration hydrogen ion in 0.1 mol dm –3 of higher 0.01 mol dm –3 of hydrochloric acid. Kepekatan ion hidrogen dalam asid hidroklorik tingg
0.1 mol dm –3 HCl mengion form HCl 0.01 mol dm –3 HCl 0.1 mol dm –3 lebih acid is rendah
1.21 Hydrochloric acid is a Asid hidroklorik adalah asid 0.1 mol dm –3 ion hidrogen: 0.1 mol dm –3 0.01 mol dm –3 hydrochloric acid is hidroklorik 0.01 mol dm –3 . lower hydrochloric acid.
Example / Contoh: Experiment Eksperimen pH meter reading Bacaan pH meter Compare – concentration of H + and pH value Bandingkan – kepekatan ion hidrogen dan nilai pH – – –
127
Nilam Publication Sdn. Bhd.
06-Chem F4 (3P).indd 127 12/9/2011 5:55:56 PM