Page 11 - Ranger Revisi Cepat 2022 - Kimia
P. 11
Kimia SPM Bab 4 Jadual Berkala Unsur
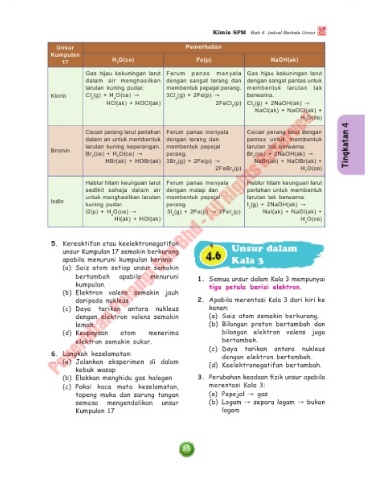
Unsur Pemerhatian
Kumpulan
17 H O(ce) Fe(p) NaOH(ak)
2
Gas hijau kekuningan larut Ferum panas menyala Gas hijau kekuningan larut
dalam air menghasilkan dengan sangat terang dan dengan sangat pantas untuk
larutan kuning pudar. membentuk pepejal perang. membentuk larutan tak
Klorin Cl (g) + H O(ce) → 3Cl (g) + 2Fe(p) → berwarna.
2
2
2
HCl(ak) + HOCl(ak) 2FeCl (p) Cl (g) + 2NaOH(ak) →
2 2
NaCl(ak) + NaOCl(ak) +
H O(ce)
2
4
Cecair perang larut perlahan Ferum panas menyala Cecair perang larut dengan
dalam air untuk membentuk dengan terang dan pantas untuk membentuk
larutan kuning keperangan. membentuk pepejal larutan tak berwarna.
Bromin
Br (ce) + H O(ce) → perang. Br (ce) + 2NaOH(ak) →
2
2
2
HBr(ak) + HOBr(ak) 3Br (g) + 2Fe(p) → NaBr(ak) + NaOBr(ak) +
2
2FeBr (p) H O(ce)
3 2
Hablur hitam keunguan larut Ferum panas menyala Hablur hitam keunguan larut
sedikit sahaja dalam air dengan malap dan perlahan untuk membentuk
untuk menghasilkan larutan membentuk pepejal larutan tak berwarna.
Iodin kuning pudar. perang. I (g) + 2NaOH(ak) →
I2(p) + H O(ce) → 3I (g) + 2Fe(p) → 2FeI (p) 2 NaI(ak) + NaOI(ak) +
2 2 3
HI(ak) + HOI(ak) H O(ce)
2
5. Kereaktifan atau keelektronegatifan
unsur Kumpulan 17 semakin berkurang 4.6 Unsur dalam
apabila menuruni kumpulan kerana: Kala 3
(a) Saiz atom setiap unsur semakin
bertambah apabila menuruni 1. Semua unsur dalam Kala 3 mempunyai
kumpulan. tiga petala berisi elektron.
(b) Elektron valens semakin jauh
daripada nukleus. 2. Apabila merentasi Kala 3 dari kiri ke
(c) Daya tarikan antara nukleus kanan:
dengan elektron valens semakin (a) Saiz atom semakin berkurang.
lemah. (b) Bilangan proton bertambah dan
(d) Keupayaan atom menerima bilangan elektron valens juga
elektron semakin sukar. bertambah.
(c) Daya tarikan antara nukleus
6. Langkah keselamatan: dengan elektron bertambah.
(a) Jalankan eksperimen di dalam (d) Keelektronegatifan bertambah.
kebuk wasap
(b) Elakkan menghidu gas halogen 3. Perubahan keadaan fizik unsur apabila
(c) Pakai kaca mata keselamatan, merentasi Kala 3:
topeng muka dan sarung tangan (a) Pepejal → gas
semasa mengendalikan unsur (b) Logam → separa logam → bukan
Kumpulan 17 logam
35
04 RANGER KIMIA TG4 2P.indd 35 06/07/2021 2:01 PM