Page 16 - E-Modul Ikatan Kimia
P. 16
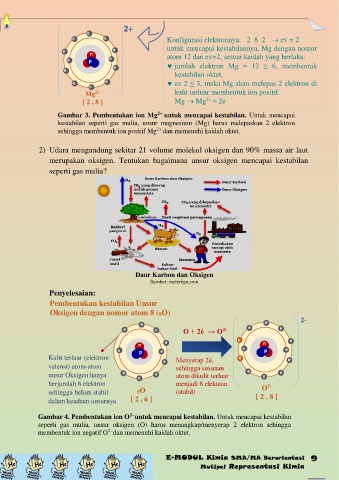
2+
e
e e Konfigurasi elektronnya: 2 8 2 → ev = 2
e e untuk mencapai kestabilannya, Mg dengan nomor
n atom 12 dan ev=2, sesuai kaidah yang berlaku:
e p e
jumlah elektron Mg = 12 ≥ 6, membentuk
e e
kestabilan oktet,
e e ev 2 ≤ 3, maka Mg akan melepas 2 elektron di
e
Mg 2+ kulit terluar membentuk ion positif.
[ 2 , 8 ] Mg → Mg + 2ѐ
2+
Gambar 3. Pembentukan ion Mg untuk mencapai kestabilan. Untuk mencapai
2+
kestabilan seperti gas mulia, unsur magnesium (Mg) harus melepaskan 2 elektron
2+
sehingga membentuk ion positif Mg dan memenuhi kaidah oktet.
2) Udara mengandung sekitar 21 volume molekul oksigen dan 90% massa air laut
merupakan oksigen. Tentukan bagaimana unsur oksigen mencapai kestabilan
seperti gas mulia?
Daur Karbon dan Oksigen
Sumber: materiipa.com
Penyelesaian:
Pembentukan kestabilan Unsur
Oksigen dengan nomor atom 8 (8O)
2-
e e
e e O + 2ѐ → O 2- e e
e e n e
n
e e e p e
p
Kulit terluar (elektron Menyerap 2ѐ, e e
valensi) atom-atom e sehingga susunan e
unsur Oksigen hanya e e e atom dikulit terluar e e
berjumlah 6 elektron menjadi 8 elektron 2-
sehingga belum stabil 8O (stabil) O
dalam keadaan unsurnya [ 2 , 6 ] [ 2 , 8 ]
Gambar 4. Pembentukan ion O untuk mencapai kestabilan. Untuk mencapai kestabilan
2-
seperti gas mulia, unsur oksigen (O) harus menangkap/menyerap 2 elektron sehingga
2-
membentuk ion negatif O dan memenuhi kaidah oktet.
E-MODUL Kimia SMA/MA Berorientasi 9
Mutipel Representasi Kimia