Page 15 - E-Modul Ikatan Kimia
P. 15
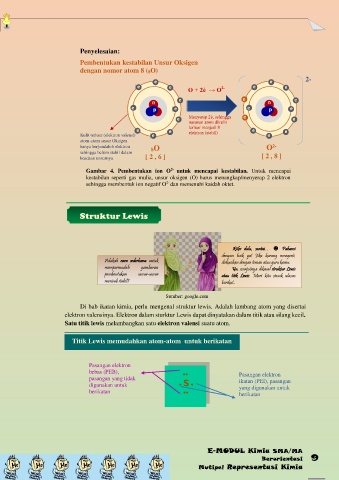
Penyelesaian:
Pembentukan kestabilan Unsur Oksigen
dengan nomor atom 8 (8O)
e e 2-
e e 2- e e
O + 2ѐ → O
e e e
n n
e p e e p e
e Menyerap 2ѐ, sehingga e e
susunan atom dikulit
e e terluar menjadi 8 e e
elektron (stabil)
Kulit terluar (elektron valensi) e e
atom-atom unsur Oksigen
hanya berjumlah 6 elektron 8O O 2-
sehingga belum stabil dalam
keadaan unsurnya [ 2 , 6 ] [ 2 , 8 ]
Gambar 4. Pembentukan ion O 2- untuk mencapai kestabilan. Untuk mencapai
kestabilan seperti gas mulia, unsur oksigen (O) harus menangkap/menyerap 2 elektron
sehingga membentuk ion negatif O dan memenuhi kaidah oktet.
2-
Struktur Lewis
Rilex dulu, santai… ☻ Pahami
dengan baik ya! Jika kurang mengerti,
Adakah cara sederhana untuk diskusikan dengan teman atau guru kamu.
mempermudah gambaran Ya, seanjutnya dikenal struktur Lewis
pembentukan unsur-unsur atau titik Lewis. Mari kita simak ulasan
menjadi stabil? berikut..
Sumber: google.com
Di bab ikatan kimia, perlu mengenal struktur lewis. Adalah lambang atom yang disertai
elektron valensinya. Elektron dalam sturktur Lewis dapat dinyatakan dalam titik atau silang kecil.
Satu titik lewis melambangkan satu elektron valensi suatu atom.
Titik Lewis memudahkan atom-atom untuk berikatan
Pasangan elektron
bebas (PEB), •• Pasangan elektron
pasangan yang tidak ikatan (PEI), pasangan
digunakan untuk • S • yang digunakan untuk
berikatan •• berikatan
E-MODUL Kimia SMA/MA
Berorientasi 9
Mutipel Representasi Kimia