Page 4 - MODUL termokimia 1
P. 4
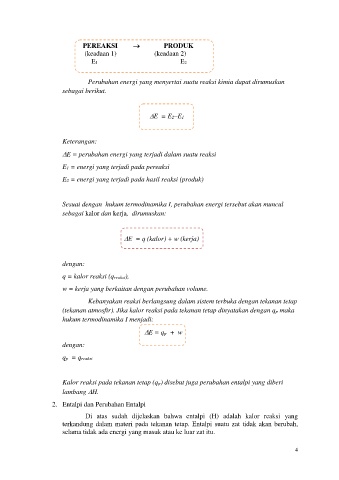
PEREAKSI PRODUK
(keadaan 1) (keadaan 2)
E1 E2
Perubahan energi yang menyertai suatu reaksi kimia dapat dirumuskan
sebagai berikut.
E = E2–E1
Keterangan:
E = perubahan energi yang terjadi dalam suatu reaksi
E1 = energi yang terjadi pada pereaksi
E2 = energi yang terjadi pada hasil reaksi (produk)
Sesuai dengan hukum termodinamika I, perubahan energi tersebut akan muncul
sebagai kalor dan kerja, dirumuskan:
E = q (kalor) + w (kerja)
dengan:
q = kalor reaksi (qreaksi),
w = kerja yang berkaitan dengan perubahan volume.
Kebanyakan reaksi berlangsung dalam sistem terbuka dengan tekanan tetap
(tekanan atmosfir). Jika kalor reaksi pada tekanan tetap dinyatakan dengan qp maka
hukum termodinamika I menjadi:
E = qp + w
dengan:
qp = qreaksi
Kalor reaksi pada tekanan tetap (qp) disebut juga perubahan entalpi yang diberi
lambang H.
2. Entalpi dan Perubahan Entalpi
Di atas sudah dijelaskan bahwa entalpi (H) adalah kalor reaksi yang
terkandung dalam materi pada tekanan tetap. Entalpi suatu zat tidak akan berubah,
selama tidak ada energi yang masuk atau ke luar zat itu.
4