Page 179 - Fisica_1_BGU
P. 179
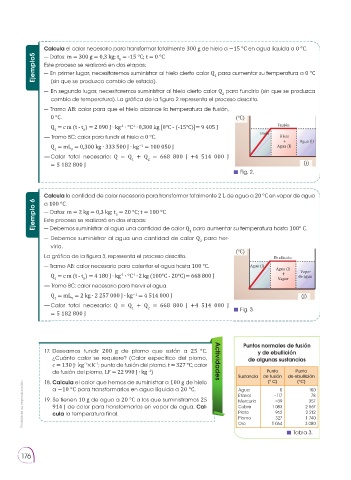
Calcula el calor necesario para transformar totalmente 300 g de hielo a −15 °C en agua líquida a 0 °C.
Ejemplo5 Este proceso se realizará en dos etapas: 1
— Datos: m = 300 g = 0,3 kg; t = -15 °C; t = 0 °C
0
— En primer lugar, necesitaremos suministrar al hielo cierto calor Q para aumentar su temperatura a 0 °C
(sin que se produzca cambio de estado).
— En segundo lugar, necesitaremos suministrar al hielo cierto calor Q para fundirlo (sin que se produzca
2 Fusión
cambio de temperatura). La gráfica de la figura 2 representa el proceso descrito.
Hielo
— Tramo AB: calor para que el hielo alcance la temperatura de fusión, Hielo Agua (l)
+
0 °C. ( C) Agua (l)
o
-1
-1
Q = c m (t - t ) = 2 090 J ∙ kg ∙ °C ∙0,300 kg [0°C - (-15°C)]= 9 405 J Fusión
2 0
— Tramo BC: calor para fundir el hielo a 0 °C. Hielo Hielo
+ Agua (l)
−1
Q = mL = 0,300 kg ∙ 333 500 J ∙ kg = 100 050 J Agua (l)
2 F
— Calor total necesario: Q = Q + Q = 668 800 J +4 514 000 J
1 2
(j)
= 5 182 800 J
Fig. 2.
Calcula la cantidad de calor necesaria para transformar totalmente 2 L de agua a 20 °C en vapor de agua
Ejemplo 6 — Datos: m = 2 kg = 0,3 kg; t = 20 °C; t = 100 °C
a 100 °C.
0
Este proceso se realizará en dos etapas:
— Debemos suministrar al agua una cantidad de calor Q para aumentar su temperatura hasta 100° C.
1
— Debemos suministrar al agua una cantidad de calor Q para her-
2
virla.
o
( C)
La gráfica de la figura 3, representa el proceso descrito. Ebullición
— Tramo AB: calor necesario para calentar el agua hasta 100 °C. Agua (l)
Agua (l)
Vapor
-1
-1
Q = c m (t - t ) = 4 180 J ∙ kg ∙ °C ∙2 kg (100°C - 20°C)= 668 800 J + de agua
1 0 Vapor
— Tramo BC: calor necesario para hervir el agua.
Ebullición
−1
Q = mL = 2 kg ∙ 2 257 000 J ∙ kg = 4 514 000 J Agua (l) (j)
2 V Agua (l)
Vapor
— Calor total necesario: Q = Q + Q = 668 800 J +4 514 000 J +
1 2 Fig. 3. Vapor de agua
= 5 182 800 J
Puntos normales de fusión
17. Deseamos fundir 200 g de plomo que están a 25 °C. y de ebullición
¿Cuánto calor se requiere? (Calor específico del plomo, de algunas sustancias
c = 130 J∙ kg ×K ; punto de fusión del plomo, t = 327 °C; calor Actividades
-1
-1
de fusión del plomo, LF = 22 990 J ∙ kg ) Punto Punto
-1
Sustancia de fusión 0 de ebullición
(°C)
(° C)
18. Calcula el calor que hemos de suministrar a 100 g de hielo
Prohibida su reproducción 19. Se tienen 10 g de agua a 20 °C a los que suministramos 25 Etanol 1 083 2 567
a −10 °C para transformarlos en agua líquida a 20 °C.
100
Agua
−117
78
Mercurio
357
−39
914 J de calor para transformarlos en vapor de agua. Cal-
Cobre
962
Plata
2 212
cula la temperatura final.
1 740
327
Plomo
1 064
Oro
3 080
Tabla 3.
176