Page 20 - กำหนดการสอน ว31221 เคม 1 ม.4_Neat
P. 20
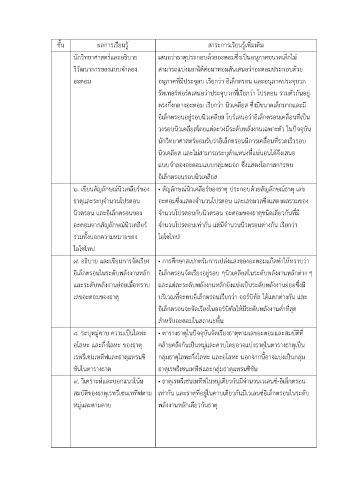
ชั้น ผลการเรียนรู้ สาระการเรียนรู้เพิ่มเติม
นักวิทยาศาสตร์และอธิบาย เสนอว่าธาตุประกอบด้วยอะตอมซึ่งเป็นอนุภาคขนาดเล็กไม่
วิวัฒนาการของแบบจำลอง สามารถแบ่งแยกได้ต่อมาทอมสันเสนอว่าอะตอมประกอบด้วย
อะตอม อนุภาคที่มีประจุลบ เรียกว่า อิเล็กตรอน และอนุภาคประจุบวก
รัทเทอร์ฟอร์ดเสนอว่าประจุบวกที่เรียกว่า โปรตอน รวมตัวกันอยู่
ตรงกึ่งกลางอะตอม เรียกว่า นิวเคลียส ซึ่งมีขนาดเล็กมากและม ี
อิเล็กตรอนอยู่รอบนิวเคลียส โบร์เสนอว่าอิเล็กตรอนเคลื่อนที่เป็น
วงรอบนิวเคลียสโดยแต่ละวงมีระดับพลังงานเฉพาะตัว ในปัจจุบัน
นักวิทยาศาสตร์ยอมรับว่าอิเล็กตรอนมีการเคลื่อนที่รวดเร็วรอบ
นิวเคลียส และไม่สามารถระบุตำแหน่งที่แน่นอนได้จึงเสนอ
แบบจำลองอะตอมแบบกลุ่มหมอก ซึ่งแสดงโอกาสการพบ
อิเล็กตรอนรอบนิวเคลียส
๖. เขียนสัญลักษณ์นิวเคลียร์ของ • สัญลักษณ์นิวเคลียร์ของธาตุ ประกอบด้วยสัญลักษณ์ธาตุ เลข
ธาตุและระบุจำนวนโปรตอน อะตอมซึ่งแสดงจำนวนโปรตอน และเลขมวลซึ่งแสดงผลรวมของ
ิ
นิวตรอน และอเล็กตรอนของ จำนวนโปรตอนกับนิวตรอน อะตอมของธาตุชนิดเดียวกันที่มี
อะตอมจากสัญลักษณ์นิวเคลียร์ จำนวนโปรตอนเท่ากัน แต่มีจำนวนนิวตรอนต่างกัน เรียกว่า
รวมทั้งบอกความหมายของ ไอโซโทป
ไอโซโทป
๗. อธิบาย และเขียนการจัดเรียง • การศึกษาสเปกตรัมการเปล่งแสงของอะตอมแก๊สทำให้ทราบว่า
อิเล็กตรอนในระดับพลังงานหลัก อิเล็กตรอนจัดเรียงอยู่รอบ ๆนิวเคลียสในระดับพลังงานหลักต่าง ๆ
และระดับพลังงานย่อยเมื่อทราบ และแต่ละระดับพลังงานหลักยังแบ่งเป็นระดับพลังงานย่อยซึ่งมี
เลขอะตอมของธาตุ บริเวณที่จะพบอิเล็กตรอนเรียกว่า ออร์บิทัล ได้แตกต่างกัน และ
อิเล็กตรอนจะจัดเรียงในออร์บิทัลให้มีระดับพลังงานต่ำที่สุด
สำหรับอะตอมในสถานะพื้น
๘. ระบุหมู่คาบ ความเป็นโลหะ • ตารางธาตุในปัจจุบันจัดเรียงธาตุตามเลขอะตอมและสมบัติที่
อโลหะ และกึ่งโลหะ ของธาตุ คล้ายคลึงกันเป็นหมู่และคาบโดยอาจแบ่งธาตุในตารางธาตุเป็น
เรพรีเซนเททีฟและธาตุแทรนซิ กลุ่มธาตุโลหะกึ่งโลหะ และอโลหะ นอกจากนี้อาจแบ่งเป็นกลุ่ม
ชันในตารางธาต ธาตุเรพรีเซนเททฟและกลุ่มธาตุแทรนซิชัน
ี
๙. วิเคราะห์และบอกแนวโน้ม • ธาตุเรพรีเซนเททีฟในหมู่เดียวกันมีจำนวนเวเลนซ์-อิเล็กตรอน
สมบัติของธาตุเรพรีเซนเททีฟตาม เท่ากัน และธาตุที่อยู่ในคาบเดียวกันมีเวเลนซ์อิเล็กตรอนในระดับ
หมู่และตามคาบ พลังงานหลักเดียวกันธาตุ