Page 157 - Fizik Tingkatan 4 KSSM
P. 157
Bab 4
Haba
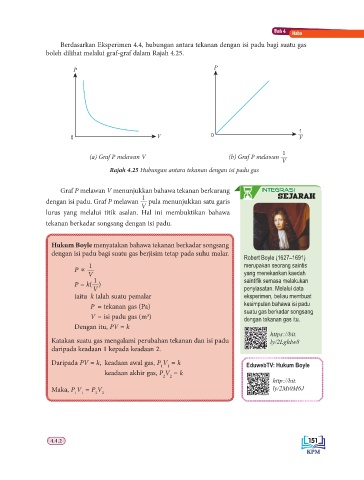
Berdasarkan Eksperimen 4.4, hubungan antara tekanan dengan isi padu bagi suatu gas
boleh dilihat melalui graf-graf dalam Rajah 4.25.
P
P
1
—
0 V 0 V
1
(a) Graf P melawan V (b) Graf P melawan
V
Rajah 4.25 Hubungan antara tekanan dengan isi padu gas
Graf P melawan V menunjukkan bahawa tekanan berkurang iNtegrasi
1 SEJARAH
dengan isi padu. Graf P melawan pula menunjukkan satu garis
V
lurus yang melalui titik asalan. Hal ini membuktikan bahawa
tekanan berkadar songsang dengan isi padu.
Hukum Boyle menyatakan bahawa tekanan berkadar songsang
dengan isi padu bagi suatu gas berjisim tetap pada suhu malar.
Robert Boyle (1627–1691)
1 merupakan seorang saintis
P ∝
V yang menekankan kaedah
1 saintifik semasa melakukan
P = k( )
V penyiasatan. Melalui data
iaitu k ialah suatu pemalar eksperimen, beliau membuat
P = tekanan gas (Pa) kesimpulan bahawa isi padu
suatu gas berkadar songsang
3
V = isi padu gas (m )
dengan tekanan gas itu.
Dengan itu, PV = k
https://bit.
Katakan suatu gas mengalami perubahan tekanan dan isi padu ly/2LghIw8
daripada keadaan 1 kepada keadaan 2.
Daripada PV = k, keadaan awal gas, P V = k
1 1 EduwebTV: Hukum Boyle
keadaan akhir gas, P V = k
2 2
http://bit.
Maka, P V = P V ly/2Mt0M6J
1 1 2 2
4.4.2 151