Page 15 - Spotlight A+ Tg 4 & 5 KIMIA KSSM
P. 15
Tg 4
Kimia Bab 5 Ikatan Kimia
Perbincangan: 4. Perubahan keadaan fizik kedua-dua sebatian
1. Magnesium klorida, MgCl bercerai di dalam diperhatikan dan direkodkan.
2
2+
air untuk menghasilkan ion magnesium Mg
dan ion klorida, Cl yang bebas bergerak. Pemerhatian: Jadual 5.8
–
2. Naftalena, C H mengandungi molekul-
10 8
molekul neutral yang tidak bercerai di dalam air. Sebatian Pemerhatian Inferens
C Takat Lebur dan Takat Didih
Magnesium Tiada MgCl mempunyai
2
Hipotesis: klorida, perubahan takat lebur yang
Sebatian ion mempunyai takat lebur dan takat didih MgCl tinggi.
2
yang tinggi manakala sebatian kovalen mempunyai
takat lebur dan takat didih yang rendah. Naftalena, Melebur C H mempunyai
©PAN ASIA PUBLICATIONS
8
10
C H dengan takat lebur yang
Pemboleh ubah: 10 8
cepat rendah.
(a) Dimanipulasikan: Jenis sebatian/ magnesium
BAB klorida, MgCl dan naftalena, C H
5 (b) Bergerak balas: Takat lebur 10 8 Kesimpulan:
2
Magnesium klorida, MgCl ialah sebatian ion dan
2
(c) Dimalarkan: Kuantiti sebatian naftalena, C H ialah sebatian kovalen. Magnesium
10 8
klorida, MgCl mempunyai takat lebur yang lebih
Prosedur: 2
tinggi daripada naftalena, C H .
10 8
Perbincangan:
1. Magnesium klorida, MgCl mengandungi ion
Air, H O 2
2 2+ – 2+
Magnesium positif, Mg dan ion negatif, Cl . Ion Mg dan
Naftalena, –
klorida, C H ion Cl tertarik antara satu sama lain oleh daya
MgCl 10 8 tarikan elektrostatik yang kuat. Banyak tenaga
2
Panaskan haba diperlukan untuk mengatasi daya tarikan
elektrostatik yang kuat. Oleh itu, takat lebur
magnesium klorida, MgCl adalah tinggi.
2
2. Naftalena, C H mengandungi molekul-
8
10
Rajah 5.38 molekul yang ditarik oleh daya tarikan van der
1. Satu spatula pepejal magnesium klorida, MgCl Waals yang lemah. Kurang tenaga haba yang
2
dimasukkan ke dalam tabung uji. diperlukan untuk mengatasi daya tarikan van
2. Satu spatula naftalena, C H dimasukkan ke der Waals yang lemah. Oleh itu, takat lebur
10 8
dalam tabung uji yang lain. naftalena, C H adalah rendah.
10
8
3. Kedua-dua tabung uji dipanaskan dalam kukus
air seperti yang ditunjukkan dalam Rajah 5.38.
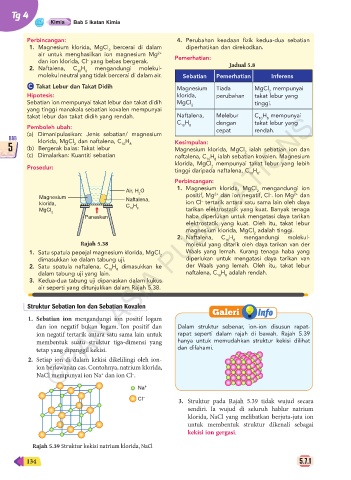
Struktur Sebatian Ion dan Sebatian Kovalen
Galeri Info
1. Sebatian ion mengandungi ion positif logam
dan ion negatif bukan logam. Ion positif dan Dalam struktur sebenar, ion-ion disusun rapat-
ion negatif tertarik antara satu sama lain untuk rapat seperti dalam rajah di bawah. Rajah 5.39
membentuk suatu struktur tiga-dimensi yang hanya untuk memudahkan struktur kekisi dilihat
tetap yang dipanggil kekisi. dan difahami.
2. Setiap ion di dalam kekisi dikelilingi oleh ion-
ion berlawanan cas. Contohnya, natrium klorida,
+
NaCl mempunyai ion Na dan ion Cl .
–
Na +
Cl – 3. Struktur pada Rajah 5.39 tidak wujud secara
sendiri. Ia wujud di seluruh hablur natrium
klorida, NaCl yang melibatkan berjuta-juta ion
untuk membentuk struktur dikenali sebagai
kekisi ion gergasi.
Rajah 5.39 Struktur kekisi natrium klorida, NaCl
134 5.7.1