Page 11 - Spotlight A+ Tg 4 & 5 KIMIA KSSM
P. 11
Tg 4
Kimia Bab 5 Ikatan Kimia
2. Takat didih:
(a) Takat didih etana, C H ialah –89 °C, manakala Galeri Info
2
6
takat didih etanol, C H OH ialah 78 °C.
2
5
(b) Daya tarikan antara molekul etana ialah Atom oksigen mempunyai cas separa negatif
manakala atom hidrogen mempunyai cas separa
daya van der Waals yang lemah. Daya positif.
tarikan antara molekul etanol ialah daya van
der Waals yang lemah dan ikatan hidrogen.
(c) Lebih banyak tenaga haba diperlukan 4. Sebatian kovalen seperti ammonia, NH dan
3
untuk mengatasi daya van der Waals dan hidrogen fluorida, HF juga boleh membentuk
memecahkan ikatan hidrogen. ikatan hidrogen dengan molekul air, H O.
2
Daya tarikan 5. Ini menerangkan mengapa ammonia, NH dan
3
©PAN ASIA PUBLICATIONS
van der Waals hidrogen fluorida, HF boleh larut di dalam air
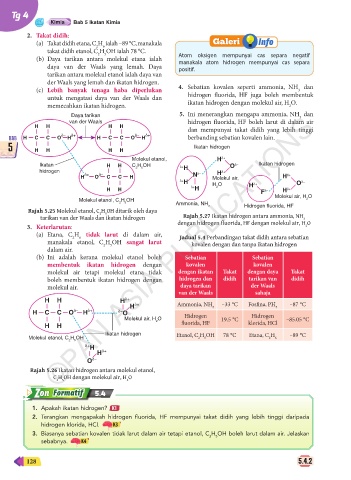
H H H H
dan mempunyai takat didih yang lebih tinggi
δ– δ+ δ– δ+
BAB H C C O H H C C O H berbanding sebatian kovalen lain.
5 H H H H Ikatan hidrogen
Molekul etanol, H δ+
Ikatan H H C H OH O δ– Ikatan hidrogen
2 5 δ+ H
hidrogen δ– H δ+
H δ+ O δ– C C H N Molekul air, H δ+
δ+ H δ+ O δ–
2
δ+ H O H
H H H δ– H δ+
F
Molekul air, H O
Molekul etanol, C H OH 2
2 5 Ammonia, NH Hidrogen fluorida, HF
Rajah 5.25 Molekul etanol, C H OH ditarik oleh daya 3
2
5
tarikan van der Waals dan ikatan hidrogen Rajah 5.27 Ikatan hidrogen antara ammonia, NH 3
3. Keterlarutan: dengan hidrogen fluorida, HF dengan molekul air, H O
2
(a) Etana, C H tidak larut di dalam air, Jadual 5.4 Perbandingan takat didih antara sebatian
6
2
manakala etanol, C H OH sangat larut kovalen dengan dan tanpa ikatan hidrogen
5
2
dalam air.
(b) Ini adalah kerana molekul etanol boleh Sebatian Sebatian
membentuk ikatan hidrogen dengan kovalen kovalen
molekul air tetapi molekul etana tidak dengan ikatan Takat dengan daya Takat
boleh membentuk ikatan hidrogen dengan hidrogen dan didih tarikan van didih
molekul air. daya tarikan der Waals
van der Waals sahaja
H H H δ+ Ammonia, NH –33 °C Fosfina, PH –87 °C
H δ+ 3 3
δ– δ+ δ–
H C C O H O Hidrogen Hidrogen
Molekul air, H O 19.5 °C –85.05 °C
2 fluorida, HF klorida, HCl
H H
Ikatan hidrogen Etanol, C H OH 78 °C Etana, C H –89 °C
Molekul etanol, C H OH 2 5 2 6
2 5
δ+
H δ+
H
δ–
O
Rajah 5.26 Ikatan hidrogen antara molekul etanol,
C H OH dengan molekul air, H O
2
5
2
Z on Formatif 5.4
1. Apakah ikatan hidrogen? K1
2. Terangkan mengapakah hidrogen fluorida, HF mempunyai takat didih yang lebih tinggi daripada
hidrogen klorida, HCl. K3
3. Biasanya sebatian kovalen tidak larut dalam air tetapi etanol, C H OH boleh larut dalam air. Jelaskan
2 5
sebabnya. K4
128 5.4.2