Page 32 - พันธะเคมี
P. 32
32
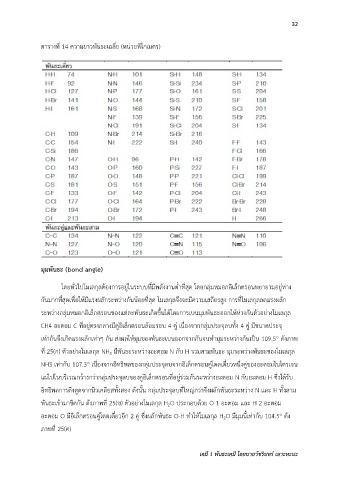
ตารางที่ 14 ความยาวพันธะเฉลี่ย (หน่วยพิโกเมตร)
มุมพันธะ (bond angle)
ี
โดยทั่วไปโมเลกุลต้องการอยู่ในระบบที่มพลังงานต่ าที่สุด โดยกลุ่มหมอกอิเล็กตรอนพยายามอยู่ห่าง
กันมากที่สุดเพื่อให้มีแรงผลักระหว่างกันน้อยที่สุด โมเลกุลจึงจะมีความเสถียรสูง การที่โมเลกุลลดแรงผลัก
ระหว่างกลุ่มหมอกอิเล็กตรอนของแต่ละพันธะเกิดขึ้นได้โดยการเบนมุมพันธะออกให้ห่างกันตัวอย่างโมเลกุล
ู่
CH4 อะตอม C ที่อยู่ตรงกลางมีคอิเล็กตรอนล้อมรอบ 4 คู่ เนื่องจากกลุ่มประจุลบทั้ง 4 คู่ มีขนาดประจุ
๐
เท่ากันจึงเกิดแรงผลักเท่าๆ กัน ส่งผลให้มุมของพันธะเบนออกจากกันจนท ามุมระหว่างกนเป็น 109.5 ดังภาพ
ั
ที่ 25(ก) ตัวอย่างโมเลกุล NH มีพันธะระหว่างอะตอม N กับ H รวมสามพันธะ มุมระหว่างพันธะของโมเลกุล
3
NH3 เท่ากับ 107.3 เนื่องจากอิทธิพลของกลุ่มประจุลบจากอิเล็กตรอนคู่โดดเดี่ยวหนึ่งคู่ของอะตอมไนโตรเจน
๐
แผ่ไปในบริเวณกว้างกว่ากลุ่มประจุลบของคู่อิเล็กตรอนที่อยู่ร่วมกันระหว่างอะตอม N กับอะตอม H ซึ่งได้รับ
อิทธิพลการดึงดูดจากนิวเคลียสทั้งสอง ดังนั้น กลุ่มประจุลบที่ใหญ่กว่าจึงผลักพันธะระหว่าง N และ H ทั้งสาม
พันธะเข้ามาชิดกัน ดังภาพที่ 25(ข) ตัวอย่างโมเลกุล H O ประกอบด้วย O 1 อะตอม และ H 2 อะตอม
2
๐
อะตอม O มีอิเล็กตรอนคู่โดดเดี่ยวอีก 2 คู่ ซึ่งผลักพันธะ O-H ท าให้โมเลกุล H O มีมุมนี้เท่ากับ 104.5 ดัง
2
ภาพที่ 25(ค)
เคมี 1 พันธะเคมี โดยนายวัชรินทร์ เลาะหะนะ