Page 37 - พันธะเคมี
P. 37
37
ื้
2
ในท านองเดียวกัน โครงแบบอิเล็กตรอนของอะตอม Be คือ 1s 2s ดังนั้นในสถานะพน Be ไม่อาจ
2
2
2
ี
เกิดสารประกอบโคเวเลนซ์ได้ เนื่องจากไม่มอิเล็กตรอนเดี่ยว และโครงแบบอิเล็กตรอนของ B เป็น 1s 2s
2p ดังนั้นควรเกิดพันธะได้เพียง 1 พันธะเท่านั้น (ตารางที่ 17) แต่ความจริงพบว่า Be และ B สามารถเกิด
1
x
พันธะโคเวเลนซ์ได้เป็นโมเลกุล BeCl และ BF ได้
2
3
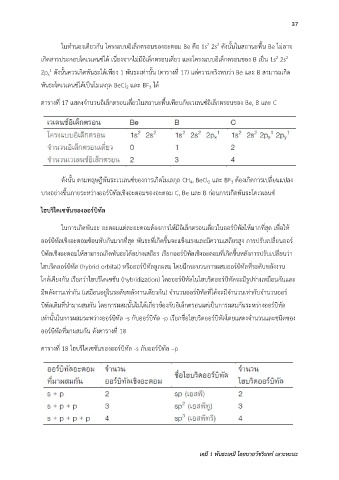
ตารางที่ 17 แสดงจ านวนอิเล็กตรอนเดี่ยวในสถานะพื้นเทียบกับเวเลนซ์อิเล็กตรอนของ Be, B และ C
ดังนั้น ตามทฤษฎีพันธะเวเลนซ์ของการเกดโมเลกุล CH , BeCl และ BF ต้องเกิดการเปลี่ยนแปลง
ิ
4
3
2
บางอย่างขึ้นภายระหว่างออร์บิทัลเชิงอะตอมของอะตอม C, Be และ B ก่อนการเกิดพันธะโคเวเลนซ์
ไฮบริไดเซชันของออร์บิทัล
ในการเกิดพันธะ อะตอมแต่ละอะตอมต้องการให้มีอิเล็กตรอนเดี่ยวในออร์บิทัลให้มากที่สุด เพื่อให้
ออร์บิทัลเชิงอะตอมซ้อนทับกนมากที่สุด พันธะที่เกิดขึ้นจะแข็งแรงและมความเสถียรสูง การปรับเปลี่ยนออร์
ี
ั
บิทัลเชิงอะตอมให้สามารถเกิดพันธะได้อย่างเสถียร เรียกออร์บิทัลเชิงอะตอมที่เกิดขึ้นหลังการปรับเปลี่ยนว่า
ไฮบริดออร์บิทัล (hybrid orbital) หรือออร์บิทัลลูกผสม โดยมีกระบวนการผสมออร์บิทัลที่ระดับพลังงาน
ใกล้เคียงกัน เรียกว่าไฮบริไดเซชัน (hybridization) โดยออร์บิทัลในไฮบริดออร์บิทัลจะมีรูปร่างเหมือนกันและ
มีพลังงานเท่ากัน (เสมือนอยู่ในระดับพลังงานเดียวกัน) จ านวนออร์บิทัลที่ได้จะมีจ านวนเท่ากับจ านวนออร์
ั
่
บิทัลเดิมที่น ามาผสมกัน โดยการผสมนั้นไมได้เกี่ยวข้องกับอิเล็กตรอนแต่เป็นการผสมกนระหว่างออร์บิทัล
เท่านั้นในการผสมระหว่างออร์บิทัล -s กับออร์บิทัล -p เรียกชื่อไฮบริดออร์บิทัลโดยแสดงจ านวนและชนิดของ
ออร์บิทัลที่มาผสมกัน ดังตารางที่ 18
ตารางที่ 18 ไฮบริไดเซชันของออร์บิทัล -s กับออร์บิทัล –p
เคมี 1 พันธะเคมี โดยนายวัชรินทร์ เลาะหะนะ