Page 11 - MODUL termokimia 1
P. 11
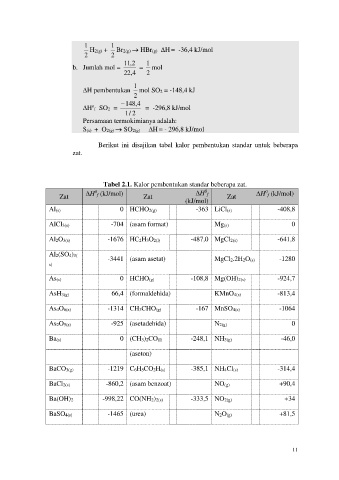
1 1
H2(g) + Br2(g) HBr(g) H = -36,4 kJ/mol
2 2
11 2 , 1
b. Jumlah mol = = mol
22 4 , 2
1
H pembentukan mol SO2 = -148,4 kJ
2
148 4 ,
o
H f SO2 = = -296,8 kJ/mol
2 / 1
Persamaan termokimianya adalah:
S(s) + O2(g) SO2(g) H = - 296,8 kJ/mol
Berikut ini disajikan tabel kalor pembentukan standar untuk beberapa
zat.
Tabel 2.1. Kalor pembentukan standar beberapa zat.
0
0
0
Zat H f (kJ/mol) Zat H f Zat H f (kJ/mol)
(kJ/mol)
Al(s) 0 HCHO2(g) -363 LiCl(s) -408,8
AlCl3(s) -704 (asam format) Mg(s) 0
Al2O3(s) -1676 HC2H3O2(l) -487,0 MgCl2(s) -641,8
Al2(SO4)3( -3441 (asam asetat) MgCl2.2H2O(s) -1280
s)
As(s) 0 HCHO(g) -108,8 Mg(OH)2(s) -924,7
AsH3(g) 66,4 (formaldehida) KMnO4(s) -813,4
As4O6(s) -1314 CH3CHO(g) -167 MnSO4(s) -1064
As2O5(s) -925 (asetadehida) N2(g) 0
Ba(s) 0 (CH3)2CO(l) -248,1 NH3(g) -46,0
(aseton)
BaCO3(g) -1219 C6H5CO2H(s) -385,1 NH4Cl(s) -314,4
BaCl2(s) -860,2 (asam benzoat) NO(g) +90,4
Ba(OH)2 -998,22 CO(NH2)2(s) -333,5 NO2(g) +34
BaSO4(s) -1465 (urea) N2O(g) +81,5
11