Page 13 - MODUL termokimia 1
P. 13
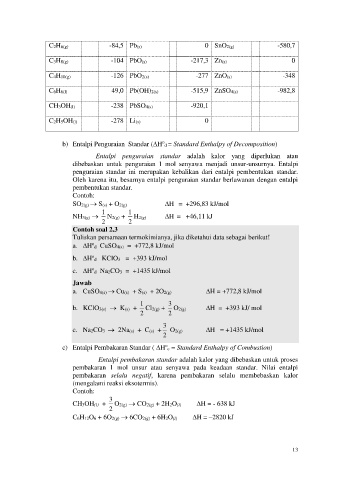
C2H6(g) -84,5 Pb(s) 0 SnO2(g) -580,7
C3H8(g) -104 PbO(s) -217,3 Zn(s) 0
C4H10(g) -126 PbO2(s) -277 ZnO(s) -348
C6H6(l) 49,0 Pb(OH)2(s) -515,9 ZnSO4(s) -982,8
CH3OH(l) -238 PbSO4(s) -920,1
C2H5OH(l) -278 Li(s) 0
o
b) Entalpi Penguraian Standar (H d = Standard Enthalpy of Decomposition)
Entalpi penguraian standar adalah kalor yang diperlukan atau
dibebaskan untuk penguraian 1 mol senyawa menjadi unsur-unsurnya. Entalpi
penguraian standar ini merupakan kebalikan dari entalpi pembentukan standar.
Oleh karena itu, besarnya entalpi penguraian standar berlawanan dengan entalpi
pembentukan standar.
Contoh:
SO2(g) S(s) + O2(g) H = +296,83 kJ/mol
1 1
NH3(g) N2(g) + H2(g) H = +46,11 kJ
2 2
Contoh soal 2.3
Tuliskan persamaan termokimianya, jika diketahui data sebagai berikut!
o
a. H d CuSO4(s) = +772,8 kJ/mol
o
b. H d KClO3 = +393 kJ/mol
o
c. H d Na2CO3 = +1435 kJ/mol
Jawab
a. CuSO4(s) Cu(s) + S(s) + 2O2(g) H = +772,8 kJ/mol
1 3
b. KClO3(s) K(s) + Cl2(g) + O2(g) H = +393 kJ/ mol
2 2
3
c. Na2CO3 2Na(s) + C(s) + O2(g) H = +1435 kJ/mol
2
o
c) Entalpi Pembakaran Standar ( H c = Standard Enthalpy of Combustion)
Entalpi pembakaran standar adalah kalor yang dibebaskan untuk proses
pembakaran 1 mol unsur atau senyawa pada keadaan standar. Nilai entalpi
pembakaran selalu negatif, karena pembakaran selalu membebaskan kalor
(mengalami reaksi eksotermis).
Contoh:
3
CH3OH(l) + O2(g) CO2(g) + 2H2O(l) H = - 638 kJ
2
C6H12O6 + 6O2(g) 6CO2(g) + 6H2O(l) H = –2820 kJ
13