Page 58 - ตำราเคมีอินทรีย์ [Jadsada Ratniyom]
P. 58
30 ความรู้เบื้องต้นของเคมีอินทรีย์
1.12 ไฮบริดไดเซชัน
(Hybridization)
พันธะโคเวเลนต์เป็นพันธะที่ความสำคัญในสารอินทรีย์เป็นอย่างยิ่ง ความเสถียรของพันธะ
ู
ั
โคเวเลนต์และการเกิดการสร้างพนธะกันนั้นมักถกอธิบายโดยใช้ทฤษฎีโมเลกุลาร์ออร์บิทัล การทำนาย
รูปร่างโมเลกุลนั้นเราจะอาศัยแนวคิดเรื่องแรงผลักของอิเล็กตรอนหรือที่รู้จักกันในนามทฤษฎี VSEPR
ในการเกิดรูปร่างของโมเลกุลนั้นไม่ได้มีเพียงแค่การซ้อนเหลื่อมของ s orbital หรือ p orbital
เพียงอย่างเดียว แต่จริงๆ แล้วจะเกี่ยวข้องกับการไฮบริดไดเซชันของอะตอมมิกออร์บิทัลด้วย การที่
ออร์บิทัลมีการ hybrid กันนี้ จะสามารถใช้อธิบายการเกิดรูปร่างโมเลกุลของสารต่าง ๆ ได้ แม้ว่า
สารอินทรีย์จะมีคาร์บอนเป็นองค์ประกอบหลัก แต่เวลาที่คาร์บอนอะตอมจะสร้างพันธะจะมีการเกิด
hybridization ซึ่งอาจเกิด hybrid orbital ที่แตกต่างกันทำให้รูปร่างโมเลกุลของสารอินทรีย์มีความ
แตกต่างกันไปด้วย
ไฮบริดไดเซชัน คือ การรวมกันของอะตอมมิกออร์บิทัลตั้งแต่สองออร์บิทัลขึ้นไป จะได้เป็น
ไฮบริดออร์บิทัลออกมาเท่ากับจำนวนของอะตอมมิกออร์บิทัลที่ใช้ ไฮบริดออร์บิทัลที่เกิดขึ้นจะมี
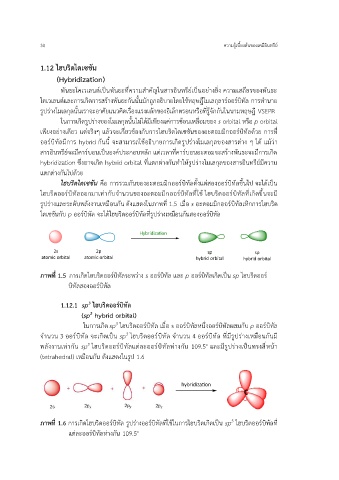
รูปร่างและระดับพลังงานเหมือนกัน ดังแสดงในภาพที่ 1.5 เมื่อ s อะตอมมิกออร์บิทัลเหิกการไฮบริด
ไดเซชันกับ p ออร์บิทัล จะได้ไฮบริดออร์บิทัลที่รูปร่างเหมือนกันสองออร์บิทัล
ภาพที่ 1.5 การเกิดไฮบริดออร์บิทัลระหว่าง s ออร์บิทัล และ p ออร์บิทัลเกิดเป็น sp ไฮบริดออร์
บิทัลสองออร์บิทัล
3
1.12.1 sp ไฮบริดออร์บิทัล
3
(sp hybrid orbital)
3
ในการเกิด sp ไฮบริดออร์บิทัล เมื่อ s ออร์บิทัลหนึ่งออร์บิทัลผสมกับ p ออร์บิทัล
3
จำนวน 3 ออร์บิทัล จะเกิดเป็น sp ไฮบริดออร์บิทัล จำนวน 4 ออร์บิทัล ที่มีรูปร่างเหมือนกันมี
พลังงานเท่ากัน sp ไฮบริดออร์บิทัลแต่ละออร์บิทัลห่างกัน 109.5° และมีรูปร่างเป็นทรงสี่หน้า
3
(tetrahedral) เหมือนกัน ดังแสดงในรูป 1.6
ภาพที่ 1.6 การเกิดไฮบริดออร์บิทัล รูปร่างออร์บิทัลที่ใช้ในการไฮบริดเกิดเป็น sp ไฮบริดออร์บิทัลที่
3
แต่ละออร์บิทัลห่างกัน 109.5°