Page 60 - ตำราเคมีอินทรีย์ [Jadsada Ratniyom]
P. 60
32 ความรู้เบื้องต้นของเคมีอินทรีย์
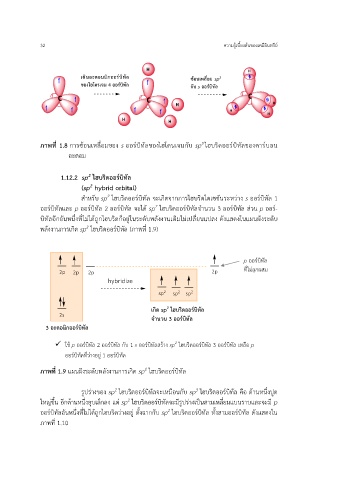
เติมอะตอมมิกออร์บิทัล ซ้อนเหลื่อม sp
3
ของไฮโดรเจน 4 ออร์บิทัล กับ s ออร์บิทัล
3
ภาพที่ 1.8 การซ้อนเหลี่อมของ s ออร์บิทัลของไฮโดนเจนกับ sp ไฮบริดออร์บิทัลของคาร์บอน
อะตอม
2
1.12.2 sp ไฮบริดออร์บิทัล
2
(sp hybrid orbital)
2
สำหรับ sp ไฮบริดออร์บิทัล จะเกิดจากการไฮบริดไดเซชันระหว่าง s ออร์บิทัล 1
2
ออร์บิทัลและ p ออร์บิทัล 2 ออร์บิทัล จะได้ sp ไฮบริดออร์บิทัลจำนวน 3 ออร์บิทัล ส่วน p ออร์-
บิทัลอีกอันหนึ่งที่ไม่ได้ถูกไฮบริดก็อยู่ในระดับพลังงานเดิมไม่เปลี่ยนแปลง ดังแสดงในแผนผังระดับ
พลังงานการเกิด sp ไฮบริดออร์บิทัล (ภาพที่ 1.9)
2
p ออร์บิทัล
ที่ไม่ถูกผสม
2
เกิด sp ไฮบริดออร์บิทัล
จำนวน 3 ออร์บิทัล
3 อะตอมิกออร์บิทัล
2
✓ ใช้ p ออร์บิทัล 2 ออร์บิทัล กับ 1 s ออร์บิทัลสร้าง sp ไฮบริดออร์บิทัล 3 ออร์บิทัล เหลือ p
ออร์บิทัลที่ว่างอยู่ 1 ออร์บิทัล
2
ภาพที่ 1.9 แผนฝังระดับพลังงานการเกิด sp ไฮบริดออร์บิทัล
3
2
รูปร่างของ sp ไฮบริดออร์บิทัลจะเหมือนกับ sp ไฮบริดออร์บิทัล คือ ด้านหนึ่งปูด
2
ใหญ่ขึ้น อีกด้านหนึ่งยุบเล็กลง แต่ sp ไฮบริดออร์บิทัลจะมีรูปร่างเป็นสามเหลี่ยมแบนราบและจะมี p
2
ออร์บิทัลอันหนึ่งที่ไม่ได้ถูกไฮบริดว่างอยู่ ตั้งฉากกับ sp ไฮบริดออร์บิทัล ทั้งสามออร์บิทัล ดังแสดงใน
ภาพที่ 1.10