Page 7 - fiches-revision_2018
P. 7
FICHES DE REVISION BAC 2018
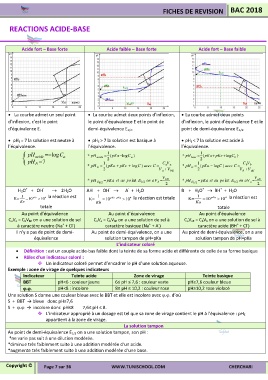
REACTIONS ACIDE-BASE
Acide fort – Base forte Acide faible – Base forte Acide fort – Base faible
La courbe admet un seul point La courbe admet deux points d’inflexion, La courbe admet deux points
d’inflexion, c’est le point le point d’équivalence E et le point de d’inflexion, le point d’équivalence E et le
d’équivalence E. demi-équivalence E 1/2. point de demi-équivalence E 1/2.
pH E = 7 la solution est neutre à pH E > 7 la solution est basique à pH E < 7 la solution est acide à
l’équivalence. l’équivalence. l’équivalence.
pH acide logC a * acide pH 1 ( pKa logC a ) * pH base 1 2 ( pKa pKe logC b )
2
pH
7
E
a a
b b
* pH E 1 ( pKa pKe log )C avec C C V * pH E 1 ( pKa log )C avec C C V
2 V a V bE 2 V b V aE
V V
* pH E 1/2 int E 1/2 on aV b pKa et au po bE * pH E 1/2 int E 1/2 on aV a pKa et au po aE
2
2
+
+
-
-
-
+
H 3O + OH 2H 2O AH + OH A + H 2O B + H 3O BH + H 2O
1 4 la réaction est 1 1 pKa 4 la réaction est
K= 10 pKe 10 K= 10 pKe pKa 10 4 la réaction est totale K= 10 10
Ke Kb Ka
totale totale
Au point d’équivalence Au point d’équivalence Au point d’équivalence
C aV a = C bV bE on a une solution de sel C aV a = C bV bE on a une solution de sel à C aV aE = C bV b on a une solution de sel à
+
+
-
-
-
+
à caractère neutre (Na + Cl ) caractère basique (Na + A ) caractère acide (BH + Cl )
Il n’y a pas de point de demi- Au point de demi-équivalence, on a une Au point de demi-équivalence, on a une
équivalence solution tampon de pH=pKa solution tampon de pH=pKa
L’indicateur coloré
Définition : est un couple acide-bas faible dont la teinte de sa forme acide et différente de celle de sa forme basique
Rôles d’un indicateur coloré :
Un indicateur coloré permet d’encadrer le pH d’une solution aqueuse.
Exemple : zone de virage de quelques indicateurs
Indicateur Teinte acide Zone de virage Teinte basique
BBT pH<6 : couleur jaune 6≤ pH ≤ 7,6 : couleur verte pH≥7,6 couleur bleue
.. pH<8 : incolore 8≤ pH ≤ 10,2 : couleur rose pH≥10,2 rose violacé
Une solution S donne une couleur bleue avec le BBT et elle est incolore avec .. d’où
S + BBT → bleue donc pH≥7,6
S + . → incolore donc pH≤8 7,6≤ pH ≤ 8.
L’indicateur approprié à un dosage est tel que sa zone de virage contient le pH à l’équivalence : pH E
appartient à la zone de virage.
La solution tampon
Au point de demi-équivalence E 1/2 on a une solution tampon, son pH :
*ne varie pas suit à une dilution modérée.
*diminue très faiblement suite à une addition modérée d’un acide.
*augmente très faiblement suite à une addition modérée d’une base.
Copyright © Page 7 sur 36 WWW.TUNISCHOOL.COM CHERCHARI