Page 4 - อัตราการเกิดปฏิกิริยาเคมี
P. 4
ิ
2. อัตรำกำรเกิดในปฏิกริยำขณะใดขณะหนึ่ง (Instantaneous rate) หมำยถึง อัตรำกำร
ิ
ื
ิ
เกิดปฏิกริยำ ณ ช่วงเวลำใดเวลำหนึ่ง หรอ ณ เวลำใดเวลำหนึ่ง อัตรำกำรเกิดปฏิกริยำนี้มีได้หลำยค่ำ
ที่เวลำต่ำงกันจะมีค่ำไม่เท่ำกัน คือ ตอนเริ่มต้นอัตรำกำรเกิดปฏิกิริยำจะมีค่ำมำก เมื่อปฏิกิริยำด ำเนิน
ไปอัตรำกำรเกิดปฏิกิริยำจะลดลงตำมลำดับเพรำะควำมเข้มข้นของสำรตั้งต้นลดลง อัตรำกำร
ิ
เกิดปฏิกริยำประเภทนี้ค ำนวณได้จำกควำมชันของกรำฟ
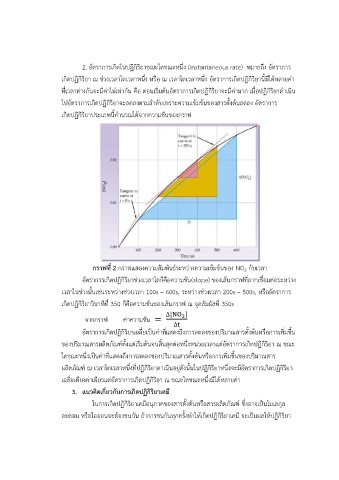
กราฟที่ 2 กรำฟแสดงควำมสัมพันธ์ระหว่ำงควำมเข้มข้นของ NO กับเวลำ
2
อัตรำกำรเกิดปฏิกริยำช่วงเวลำใดก็คือควำมชัน(slope) ของเส้นกรำฟที่ลำกเชื่อมต่อระหว่ำง
ิ
ื
เวลำในช่วงนั้นเช่นระหว่ำงช่วงเวลำ 100s – 600s, ระหว่ำงช่วงเวลำ 200s – 500s, หรออัตรำกำร
ี่
ี่
เกิดปฏิกริยำวินำทีท 350 ก็คือควำมชันของเส้นกรำฟ ณ จุดสัมผัสท 350s
ิ
∆[NO ]
จำกกรำฟ ค่ำควำมชัน = 2
∆t
อัตรำกำรเกิดปฏิกริยำเฉลี่ยเป็นค่ำที่แสดงถึงกำรลดลงของปริมำณสำรตั้งต้นหรือกำรเพิ่มขึ้น
ิ
ของปริมำณสำรผลิตภัณฑ์ตั้งแต่เริ่มต้นจนสิ้นสุดต่อหนึ่งหน่วยเวลำแต่อัตรำกำรเกิดปฏิกิรยำ ณ ขณะ
ิ
ื
ใดขณะหนึ่งเป็นค่ำที่แสดงถึงกำรลดลงของปริมำณสำรตั้งต้นหรอกำรเพิ่มขึ้นของปริมำณสำร
ิ
ผลิตภัณฑ์ ณ เวลำใดเวลำหนึ่งทปฏิกริยำดำเนินอยู่ดังนั้นในปฏิกริยำหนึ่งจะมีอัตรำกำรเกิดปฏิกิริยำ
ี่
ิ
เฉลี่ยเพียงค่ำเดียวแต่อัตรำกำรเกิดปฏิกิริยำ ณ ขณะใดขณะหนึ่งมีได้หลำยค่ำ
3. แนวคิดเกี่ยวกับการเกิดปฏิกิริยาเคมี
ิ
ในกำรเกิดปฏิกริยำเคมีอนุภำคของสำรตั้งต้นหรือสำรผลิตภัณฑ์ ซึ่งอำจเป็นโมเลกุล
ิ
อะตอม หรอไอออนจะต้องชนกัน ถ้ำกำรชนกันทุกครงท ำให้เกิดปฏิกิริยำเคมี จะเป็นผลให้ปฏิกริยำ
ั้
ื