Page 7 - อัตราการเกิดปฏิกิริยาเคมี
P. 7
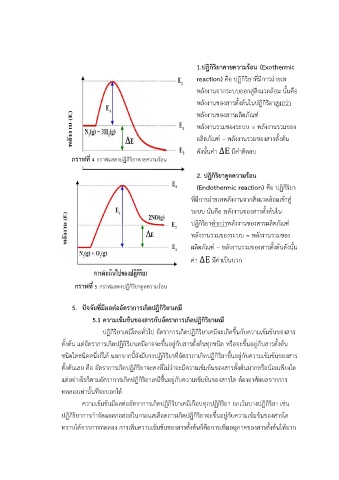
1.ปฏิกิริยาคายความร้อน (Exothermic
ิ
reaction) คือ ปฏิกริยำที่มีกำรถ่ำยเท
พลังงำนจำกระบบออกสู่สงแวดล้อม นั้นคือ
ิ่
พลังงำนของสำรตั้งต้นในปฏิกริยำสูงกว่ำ
ิ
พลังงำนของสำรผลิตภัณฑ์
พลังงำนรวมของระบบ = พลังงำนรวมของ
ผลิตภัณฑ์ – พลังงำนรวมของสำรตั้งต้น
ดังนั้นค่ำ ∆E มีค่ำติดลบ
กราฟที่ 4 กรำฟแสดงปฏิกิริยำคำยควำมร้อน
2. ปฏิกิริยาดูดความร้อน
(Endothermic reaction) คือ ปฏิกิริยำ
ที่มีกำรถ่ำยเทพลังงำนจำกสิ่งแวดลอมเข้ำส ู่
้
ระบบ นั่นคือ พลังงำนของสำรตั้งต้นใน
ปฏิกิริยำต่ ำกว่ำพลังงำนของสำรผลิตภัณฑ์
พลังงำนรวมของระบบ = พลังงำนรวมของ
ผลิตภัณฑ์ – พลังงำนรวมของสำรตั้งต้นดังนั้น
ค่ำ ∆E มีค่ำเป็นบวก
กราฟที่ 5 กรำฟแสดงปฏิกิริยำดดควำมร้อน
ู
5. ปัจจัยที่มีผลต่ออัตราการเกิดปฏิกิริยาเคมี
5.1 ความเข้มข้นของสารกับอัตราการเกิดปฏิกิริยาเคมี
ปฏิกิริยำเคมีโดยทั่วไป อัตรำกำรเกิดปฏิกิริยำเคมีจะเกิดขึ้นกับควำมเข้มข้นของสำร
ั
ื
ตั้งต้น แต่อัตรำกำรเกิดปฏิกริยำเคมีอำจจะขึ้นอยู่กับสำรตั้งต้นทุกชนิด หรอจะขึ้นอยู่กบสำรตั้งต้น
ิ
ี่
ิ
ชนิดใดชนิดหนึ่งก็ได้ นอกจำกนี้ยังมีบำงปฏิกริยำทอัตรำกำเกิดปฏิกริยำขึ้นอยู่กับควำมเข้มข้นของสำร
ิ
ตั้งต้นเลย คือ อัตรำกำรเกิดปฏิกิริยำจะคงที่ไม่ว่ำจะมีควำมเข้มข้นของสำรตั้งต้นมำกหรือน้อยเพียงใด
แต่อย่ำงไรก็ตำมอัตรำกำรเกิดปฏิกิริยำเคมีขึ้นอยู่กับควำมเข้มข้นของสำรใด ต้องอำศัยผลจำกกำร
ทดลองเท่ำนั้นที่จะบอกได้
ิ
ื
ควำมเข้มข้นมีผลต่ออัตรำกำรเกิดปฏิกริยำเคมีเกอบทุกปฏิกิริยำ ยกเว้นบำงปฏิกิริยำ เช่น
ื
ปฏิกิริยำกำรกำจัดแอลกอฮอล์ในกระแสเลอดกำรเกิดปฏิกิริยำจะขึ้นอยู่กับควำมเข้มข้นของสำรใด
ทรำบได้จำกกำรทดลอง กำรเพิ่มควำมเข้มข้นของสำรตั้งต้นก็คือกำรเพิ่มอนุภำคของสำรตั้งต้นให้มำก