Page 117 - Nilam_Publication_module_Chemistry_Form.pdf
P. 117
Chemistry Form 4 • MODULE
ACID / ASID
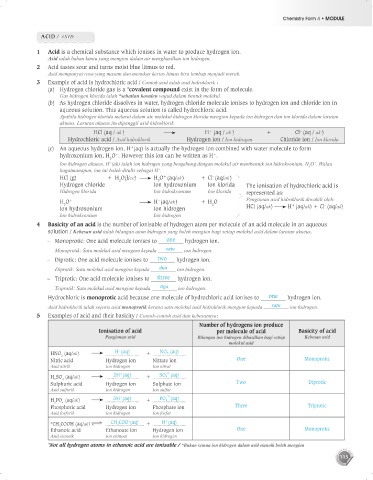
1 Acid is a chemical substance which ionises in water to produce hydrogen ion.
Asid ialah bahan kimia yang mengion dalam air menghasilkan ion hidrogen.
2 Acid tastes sour and turns moist blue litmus to red.
Asid mempunyai rasa yang masam dan menukar kertas litmus biru lembap menjadi merah.
3 Example of acid is hydrochloric acid / Contoh asid ialah asid hidroklorik :
(a) Hydrogen chloride gas is a *covalent compound exist in the form of molecule.
Gas hidrogen klorida ialah *sebatian kovalen wujud dalam bentuk molekul.
(b) As hydrogen chloride dissolves in water, hydrogen chloride molecule ionises to hydrogen ion and chloride ion in
aqueous solution. This aqueous solution is called hydrochloric acid.
Apabila hidrogen klorida melarut dalam air, molekul hidrogen klorida mengion kepada ion hidrogen dan ion klorida dalam larutan
akueus. Larutan akueus itu dipanggil asid hidroklorik.
HCl (aq / ak ) H (aq / ak ) + Cl (aq / ak )
–
+
Hydrochloric acid / Asid hidroklorik Hydrogen ion / Ion hidrogen Chloride ion / Ion klorida
+
(c) An aqueous hydrogen ion, H (aq) is actually the hydrogen ion combined with water molecule to form
hydroxonium ion, H O . However this ion can be written as H .
+
+
3
+
+
Ion hidrogen akueus, H (ak) ialah ion hidrogen yang bergabung dengan molekul air membentuk ion hidroksonium, H O . Walau
3
+
bagaimanapun, ion ini boleh ditulis sebagai H .
HCl (g) + H O(l/ce) H O (aq/ak) + Cl (aq/ak)
–
+
3
2
Hydrogen chloride Ion hydroxonium Ion klorida The ionisation of hydrochloric acid is
Hidrogen klorida Ion hidroksonium Ion klorida represented as:
H O H (aq/ak) + H O Pengionan asid hidroklorik diwakili oleh:
+
+
2
3
+
–
Ion hydroxonium Ion hidrogen HCl (aq/ak) H (aq/ak) + Cl (aq/ak)
Ion hidroksonium Ion hidrogen
4 Basicity of an acid is the number of ionisable of hydrogen atom per molecule of an acid molecule in an aqueous
solution / Kebesan asid ialah bilangan atom hidrogen yang boleh mengion bagi setiap molekul asid dalam larutan akueus.
– Monoprotic: One acid molecule ionises to one hydrogen ion.
Monoprotik: Satu molekul asid mengion kepada satu ion hidrogen.
– Diprotic: One acid molecule ionises to two hydrogen ion.
Diprotik: Satu molekul asid mengion kepada dua ion hidrogen.
– Triprotic: One acid molecule ionises to three hydrogen ion.
Triprotik: Satu molekul asid mengion kepada tiga ion hidrogen.
Hydrochloric is monoprotic acid because one molecule of hydrochloric acid ionises to one hydrogen ion.
Asid hidroklorik ialah sejenis asid monoprotik kerana satu molekul asid hidroklorik mengion kepada satu ion hidrogen.
5 Examples of acid and their basicity / Contoh-contoh asid dan kebesannya:
Number of hydrogens ion produce
Ionisation of acid per molecule of acid Basicity of acid
Pengionan asid Bilangan ion hidrogen dihasilkan bagi setiap Kebesan asid
molekul asid
–
+
HNO (aq/ak) H (aq) + NO 3 (aq)
3
Nitric acid Hydrogen ion Nitrate ion One Monoprotic
Asid nitrik Ion hidrogen Ion nitrat
2–
+
H SO (aq/ak) 2H (aq) + SO 4 (aq)
2 4
Sulphuric acid Hydrogen ion Sulphate ion Two Diprotic
Asid sulfurik Ion hidrogen Ion sulfat
3–
+
H PO (aq/ak) 3H (aq) + PO 4 (aq)
3 4
Phosphoric acid Hydrogen ion Phosphate ion Three Triprotic
Asid fosforik Ion hidrogen Ion fosfat
+
–
*CH COOH (aq/ak) CH 3 COO (aq) + H (aq)
3
Ethanoic acid Ethanoate ion Hydrogen ion One Monoprotic
Asid etanoik Ion etanoat Ion hidrogen
*Not all hydrogen atoms in ethanoic acid are ionisable / *Bukan semua ion hidrogen dalam asid etanoik boleh mengion
115
Nilam Publication Sdn. Bhd.
06-Chem F4 (3P).indd 115 12/9/2011 5:55:53 PM