Page 18 - MODUL termokimia 1
P. 18
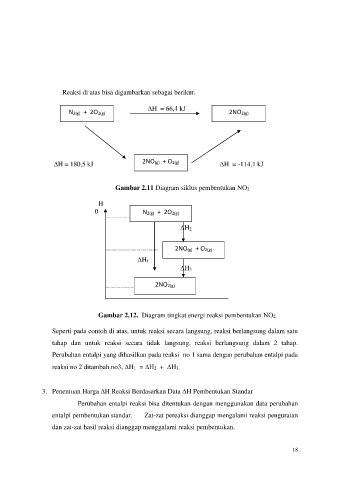
Reaksi di atas bisa digambarkan sebagai berikut.
H = 66,4 kJ 2NO2(g)
N2(g) + 2O2(g)
2NO(g) + O2(g)
H = 180,5 kJ H = -114,1 kJ
Gambar 2.11 Diagram siklus pembentukan NO2
H
0 N2(g) + 2O2(g)
H2
2NO(g) + O2(g)
H1
H3
2NO2(g)
Gambar 2.12. Diagram tingkat energi reaksi pembentukan NO2
Seperti pada contoh di atas, untuk reaksi secara langsung, reaksi berlangsung dalam satu
tahap dan untuk reaksi secara tidak langsung, reaksi berlangsung dalam 2 tahap.
Perubahan entalpi yang dihasilkan pada reaksi no 1 sama dengan perubahan entalpi pada
reaksi no 2 ditambah no3, H1 = H2 + H3.
3. Penentuan Harga H Reaksi Berdasarkan Data H Pembentukan Standar
Perubahan entalpi reaksi bisa ditentukan dengan menggunakan data perubahan
entalpi pembentukan standar. Zat-zat pereaksi dianggap mengalami reaksi penguraian
dan zat-zat hasil reaksi dianggap menggalami reaksi pembentukan.
18