Page 93 - ธรรมชาติของสิ่งมีชีวิต
P. 93
ิ
ชีววทยาพื้นฐาน ม.4 - 87 -
่
กระบวนการสลายแรงยึดเหนี่ยวระหวางอะตอมของสารตั้งต้น เกิดขึ้นได้โดยโมเลกุลของสารตั้งต้นจะ
รับเอาพลังงานจากภายนอกเข้าไปช่วยท าลายแรงยึดเหนี่ยวระหว่างอะตอมท าให้เกิดเป็นอะตอมอสระ
ิ
ึ
กระบวนการสร้างแรงยดเหนี่ยวระหว่างอะตอมของสารผลิตภัณฑ เกิดขึ้นได้โดยอะตอมของสารต่าง ๆ
์
จะเข้ารวมกันกลายเป็นผลิตภัณฑ์และมีการปลดปล่อยพลังงานภายในที่เป็นส่วนเกินออกมา เพอให้อะตอม
ื่
ของสารสร้างแรงยึดเหนี่ยวต่อกันได้
ปฏิกิริยาเคมีจะเกิดขึ้นได้ เมื่อสารตั้งต้นมีการสลายแรงยึดเหนี่ยวระหว่างอะตอมเกิดเป็นอะตอม
อิสระ จากนั้นอะตอมอิสระจึงจะเข้าสร้างแรงยึดเหนี่ยวกับอะตอมของสารตั้งต้นอื่น ๆ เพื่อเกิดเป็นผลิตภัณฑ์
ที่เป็นสารชนิดใหม่ ซึ่งการเปลี่ยนแปลงในแต่ละขั้นจะมีการใช้พลังงานในลักษณะที่แตกต่างกัน โดยผลลัพธ์
ของการใช้พลังงานจากทั้งสองขั้นตอนจะเป็นตัวตัดสินว่า ปฏิกิริยาเคมีไปในทิศทางใด
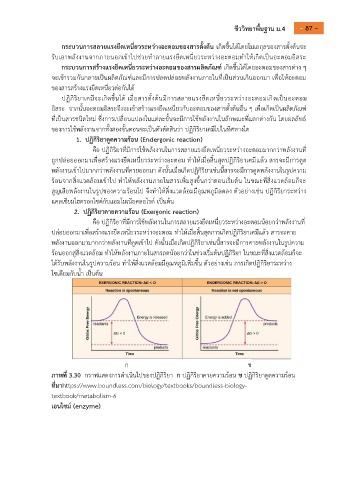
1. ปฏิกิริยาดูดความร้อน (Endergonic reaction)
คือ ปฏิกิริยาที่มีการใช้พลังงานในการสลายแรงยึดเหนี่ยวระหว่างอะตอมมากกว่าพลังงานที่
ื่
ถูกปล่อยออกมาเพอสร้างแรงยึดเหนี่ยวระหว่างอะตอม ท าให้เมื่อสิ้นสุดปฏิกิริยาเคมีแล้ว สารจะมีการดูด
พลังงานเข้าไปมากกว่าพลังงานที่คายออกมา ดังนั้นเมื่อเกิดปฏิกิริยาเช่นนี้สารจะมีการดูดพลังงานในรูปความ
ร้อนจากสิ่งแวดล้อมเข้าไป ท าให้พลังงานภายในสารเพมสูงขึ้นกว่าตอนเริ่มต้น ในขณะที่สิ่งแวดล้อมก็จะ
ิ่
สูญเสียพลังงานในรูปของความร้อนไป จึงท าให้สิ่งแวดล้อมมีอณหภูมิลดลง ตัวอย่างเช่น ปฏิกิริยาระหว่าง
ุ
แคลเซียมไฮดรอกไซด์กับแอมโมเนียคลอไรด์ เป็นต้น
2. ปฏิกิริยาคายความร้อน (Exergonic reaction)
คือ ปฏิกิริยาที่มีการใช้พลังงานในการสลายแรงยึดเหนี่ยวระหว่างอะตอมน้อยกว่าพลังงานที่
ปล่อยออกมาเพอสร้างแรงยึดเหนี่ยวระหว่างอะตอม ท าให้เมื่อสิ้นสุดการเกิดปฏิกิริยาเคมแล้ว สารจะคาย
ี
ื่
พลังงานออกมามากกว่าพลังงานที่ดูดเข้าไป ดังนั้นเมื่อเกิดปฏิกิริยาเช่นนี้สารจะมีการคายพลังงานในรูปความ
ร้อนออกสู่สิ่งแวดล้อม ท าให้พลังงานภายในสารลดน้อยกว่าในช่วงเริ่มต้นปฏิกิริยา ในขณะที่สิ่งแวดล้อมก็จะ
ได้รับพลังงานในรูปความร้อน ท าให้สิ่งแวดล้อมมีอณหภูมิเพิ่มขึ้น ตัวอย่างเช่น การเกิดปฏิกิริยาระหว่าง
ุ
โซเดียมกับน้ า เป็นต้น
ก ข
ภาพที่ 3.30 กราฟแสดงการด าเนินไปของปฏิกิริยา ก ปฏิกิริยาคายความร้อน ข ปฏิกิริยาดูดความร้อน
ที่มาhttps://www.boundless.com/biology/textbooks/boundless-biology-
textbook/metabolism-6
์
เอนไซม (enzyme)