Page 558 - ตำราเคมีอินทรีย์ [Jadsada Ratniyom]
P. 558
530 เคมีอินทรีย์ (Org. Chem)
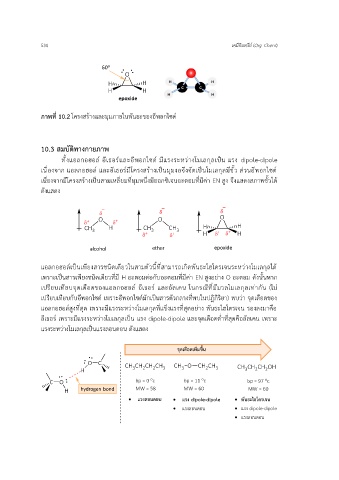
ภาพที่ 10.2 โครงสร้างและมุมภายในพันธะของอีพอกไซด์
10.3 สมบัติทางกายภาพ
ทั้งแอลกอฮอล์ อีเธอร์และอีพอกไซด์ มีแรงระหว่างโมเลกุลเป็น แรง dipole-dipole
เนื่องจาก แอลกอฮอล์ และอีเธอร์มีโครงสร้างเป็นมุมงอจึงจัดเป็นโมเลกุลมีขั้ว ส่วนอีพอกไซด์
เนื่องจากมีโครงสร้างเป็นสามเหลี่ยมที่มุมหนึ่งมีออกซิเจนอะตอมที่มีค่า EN สูง จึงแสดงสภาพขั้วได้
ดังแสดง
แอลกอฮอล์เป็นเพียงสารชนิดเดียวในสามตัวนี้ที่สามารถเกิดพันธะไฮโดรเจนระหว่างโมเลกุลได้
เพราะเป็นสารเพียงชนิดเดียวที่มี H อะตอมต่อกับอะตอมที่มีค่า EN สูงอย่าง O อะตอม ดังนั้นหาก
เปรียบเทียบจุดเดือดของแอลกอฮอล์ อีเธอร์ และอัลเคน ในกรณีที่มีมวลโมเลกุลเท่ากัน (ไม่
ี
ี
เปรียบเทียบกับอพอกไซด์ เพราะอพอกไซด์มักเป็นสารตัวกลางที่พบในปฏิกิริยา) พบว่า จุดเดือดของ
แอลกอฮอล์สูงที่สุด เพราะมีแรงระหว่างโมเลกุลที่แข็งแรงที่สุดอย่าง พันธะไฮโดรเจน รองลงมาคือ
อีเธอร์ เพราะมีแรงระหว่างโมเลกุลเป็น แรง dipole-dipole และจุดเดือดต่ำที่สุดคืออัลเคน เพราะ
แรงระหว่างโมเลกุลเป็นแรงลอนดอน ดังแสดง
จุดเดือดเพิ่มขึ้น
• แรงลอนดอน • แรง dipole-dipole • พันธะไฮโดรเจน
• แรงลอนดอน • แรง dipole-dipole
• แรงลอนดอน