Page 10 - อัตราการเกิดปฏิกิริยาเคมี
P. 10
Mg จะติดไปเช่นนี้เนื่องจำก Mg รวมกัน O2จะคำยควำมร้อยออกมำจ ำนวนหนึ่งควำมร้อยที่คำย
ออกมำนี้จะช่วยให้ปฏิกิริยำด ำเนินต่อไปได้เอง
ิ
2. ปฏิกริยำระหว่ำง H กับ O ได้เป็น H O ตำมสมกำร 2H + O → 2H O ปฏิกิริยำนี้มี
2
2
2
2
2
2
พลังงำนก่อกัมมันต์หรือพลังงำนกระตุ้นค่อนข้ำงสูงท ำให้ปฏิกริยำเกิดยำกกำรเพิ่มหองจึงไม่
้
ิ
ิ
ิ
๊
่
ิ
เกดปฏิกริยำแต่ถ้ำเพิ่มอุณหภูมิให้แกระบบโดยกำรจุดไฟเผำกำซผสม H + O แจะพบว่ำเกิดปฏิกริยำ
2
2
ได้ H O ทันท ี
2
ุ
จำกตัวอย่ำงแสดงให้เห็นว่ำอณหภูมิมีผลโดยตรงต่ออัตรำกำรเกิดปฏิกิริยำอณหภูมิทำให้
ุ
่
เกิดปฏิกริยำได้เร็วขึ้นในแงของทฤษฎีกำรชนกันของโมเลกุลสำมำรถอธิบำยผลของอุณหภูมิได้ดังนี้
ิ
็
1 กำรเพิ่มอณหภูมิท ำให้อนุภำคมีควำมเรวมำกขึ้นซึ่งโอกำสชนกันย่อมมำกขึ้น
ุ
ุ
ื
2 กำรเพิ่มอณหภูมิท ำให้จ ำนวนอนุภำคของสำรที่มีพลังงำนจลน์สูงมีค่ำเท่ำกับหรอมำกกว่ำ
พลังงำนก่อกัมมันต์เพิ่มขึ้น
ี่
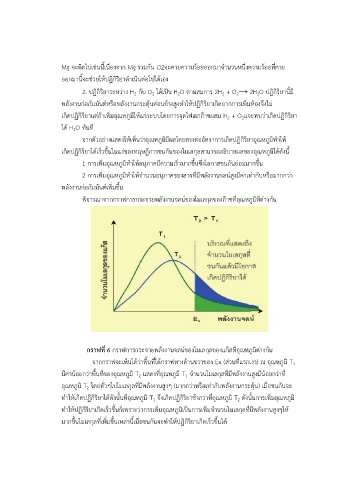
พิจำรณำจำกกรำฟกำรกระจำยพลงงำนจลน์ของโมเลกุลของกำซทอุณหภูมิที่ต่ำงกัน
๊
ั
ุ
กราฟที่ 6 กรำฟกำรกระจำยพลังงำนจลน์ของโมเลกุลของแก๊สที่อณหภูมิต่ำงกัน
จำกกรำฟจะเห็นได้ว่ำพื้นที่ใต้กรำฟทำงด้ำนขวำของ Ea (ส่วนที่แรกเงำ) ณ อุณหภูมิ T
1
ุ
มีค่ำน้อยกว่ำพื้นที่ของอุณหภูมิ T แสดงที่อณหภูมิ T จ ำนวนโมเลกุลที่มีพลังงำนสูงมีน้อยกว่ำท ี่
1
2
อุณหภูมิ T โดยทั่วๆไปโมเลกุลที่มีพลงงำนสูงๆ (มำกกว่ำหรอเทำกับพลังงำนกระตุ้น) เมื่อชนกันจะ
ั
่
ื
2
ิ
ท ำให้เกิดปฏิกริยำได้ดังนั้นที่อณหภูมิ T จึงเกิดปฏิกิริยำช้ำกว่ำทอณหภูมิ T ดังนั้นกำรเพิ่มอุณหภูมิ
ุ
ี่
ุ
1
2
ท ำให้ปฏิกิริยำเกิดเร็วขึ้นก็เพรำะวำกำรเพิ่มอุณหภูมิเป็นกำรเพิ่มจ ำนวนโมเลกุลที่มีพลังงำนสูงๆให ้
่
มำกขึ้นโมเลกุลที่เพิ่มขึ้นเหล่ำนี้เมื่อชนกันจะทำให้ปฏิกิริยำเกิดเร็วขึ้นได้