Page 22 - ชุดกิจกรรมอัตราการเกิดปฏิกิริยาเคมี
P. 22
22
ุ
ื
2 กำรเพิ่มอณหภูมิท ำให้จ ำนวนอนุภำคของสำรที่มีพลังงำนจลน์สูงมีค่ำเท่ำกับหรอมำกกว่ำพลังงำน
ก่อกัมมันต์เพิ่มขึ้น
ั
พิจำรณำจำกกรำฟกำรกระจำยพลงงำนจลน์ของโมเลกุลของกำซทอุณหภูมิที่ต่ำงกัน
๊
ี่
ุ
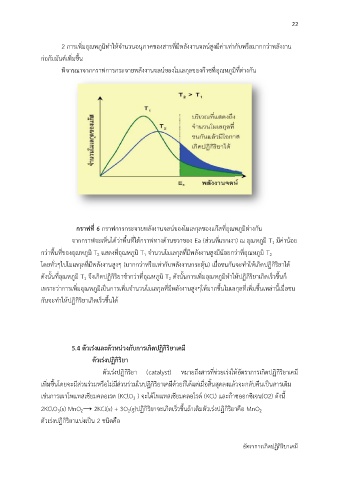
กราฟที่ 6 กรำฟกำรกระจำยพลังงำนจลน์ของโมเลกุลของแก๊สที่อณหภูมิต่ำงกัน
จำกกรำฟจะเห็นได้ว่ำพื้นที่ใต้กรำฟทำงด้ำนขวำของ Ea (ส่วนที่แรกเงำ) ณ อุณหภูมิ T มีค่ำน้อย
1
ี่
ุ
กว่ำพื้นที่ของอุณหภูมิ T แสดงที่อุณหภูมิ T จ ำนวนโมเลกุลที่มีพลังงำนสูงมีน้อยกว่ำทอณหภูมิ T
2
2
1
โดยทั่วๆไปโมเลกุลที่มีพลังงำนสูงๆ (มำกกว่ำหรอเท่ำกับพลังงำนกระตุ้น) เมื่อชนกันจะทำให้เกิดปฏิกิริยำได้
ื
ดังนั้นที่อุณหภูมิ T จึงเกิดปฏิกิริยำช้ำกว่ำทอุณหภูมิ T ดังนั้นกำรเพิ่มอุณหภูมิทำให้ปฏิกิริยำเกิดเร็วขึ้นก ็
ี่
1
2
ี่
เพรำะวำกำรเพิ่มอุณหภูมิเป็นกำรเพิ่มจ ำนวนโมเลกุลที่มีพลังงำนสูงๆให้มำกขึ้นโมเลกุลทเพิ่มขึ้นเหล่ำนี้เมื่อชน
่
กันจะท ำให้ปฏิกิริยำเกิดเรวขึ้นได้
็
5.4 ตัวเร่งและตวหน่วงกับการเกิดปฏิกิริยาเคมี
ั
ตัวเร่งปฏิกิริยา
ตัวเร่งปฏิกิริยำ (catalyst) หมำยถึงสำรที่ช่วยเร่งให้อัตรำกำรเกิดปฏิกิริยำเคมี
ื
เพิ่มขึ้นโดยจะมีส่วนร่วมหรอไม่มีส่วนรวมในปฏิกริยำเคมีด้วยก็ได้แต่เมื่อสิ้นสุดลงแล้วจะกลับคืนเป็นสำรเดิม
ิ
่
เช่นกำรเผำโพแทสเซียมคลอเรต (KClO ) จะได้โพแทสเซียมคลอไรด์ (KCl) และก๊ำซออกซิเจน(O2) ดังนี้
3
่
2KClO (s) MnO → 2KCl(s) + 3O (g)ปฏิกริยำจะเกิดเร็วขึ้นถ้ำเติมตัวเรงปฏิกิริยำคือ MnO
ิ
2
3
2
2
ตัวเร่งปฏิกิริยำแบ่งเป็น 2 ชนิดคือ
ิ
ิ
อัตราการเกดปฏิกริยาเคมี