Page 155 - เคมีสำหรับครู 2
P. 155
เคมีสำหรับครู 2 (Chem. for teachers 2) 131
จากภาพที่ 4.6 จะเห็นว่าครึ่งเซลล์ของ Zn เป็นแอโนด ครึ่งเซลล์ของไฮโดรเจนเป็น
o
แคโทด (E = 0.00 V ) ค่าที่อ่านได้จากโวลต์มิเตอร์ คือ 0.76 โวลต์ เมื่อนำมาแทนค่าในสมการ
2 H
o
E = E o - E o
cell cathode anode
จะได้ E = E - E
o
o
o
cell 2 H Zn
0.76 = (0.00) - E o
Zn
o
E = -0.76 V
Zn
ดังนั้นจะได้ว่า ค่าศักย์ไฟฟ้าของครึ่งเซลล์มาตรฐานของ Zn จะมีค่าเท่ากับ -0.76 โวลต์ เมื่อมีการทำ
การวัดค่าศักย์ไฟฟ้ามาตรฐานของครึ่งเซลล์อื่น ๆ โดยการต่อครึ่งเซลล์นั้นกับ ครึ่งเซลล์ไฮโดรเจน จน
ได้ค่าศักย์ไฟฟ้าของครึ่งปฏิกิริยา หลายปฏิกิริยาดังแสดงในตารางที่ 4.2
ั
้
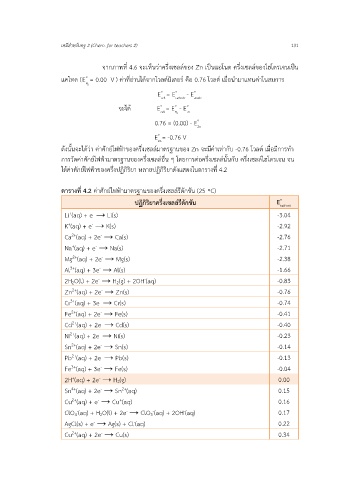
ตารางที่ 4.2 ค่าศกย์ไฟฟามาตรฐานของครึ่งเซลล์รีดักชัน (25 ◦C)
ปฏิกิริยาครึ่งเซลล์รีดักชัน E o half-cell
+
-
Li (aq) + e → Li(s) -3.04
+
-
K (aq) + e → K(s) -2.92
2+
-
Ca (aq) + 2e → Ca(s) -2.76
+
-
Na (aq) + e → Na(s) -2.71
-
2+
Mg (aq) + 2e → Mg(s) -2.38
-
3+
Al (aq) + 3e → Al(s) -1.66
-
-
2H2O(l) + 2e → H2(g) + 2OH(aq) -0.83
2+
-
Zn (aq) + 2e → Zn(s) -0.76
-
3+
Cr (aq) + 3e → Cr(s) -0.74
2+
-
Fe (aq) + 2e → Fe(s) -0.41
2+
-
Cd (aq) + 2e → Cd(s) -0.40
2+
-
Ni (aq) + 2e → Ni(s) -0.23
-
2+
Sn (aq) + 2e → Sn(s) -0.14
-
2+
Pb (aq) + 2e → Pb(s) -0.13
3+
-
Fe (aq) + 3e → Fe(s) -0.04
-
+
2H (aq) + 2e → H2(g) 0.00
2+
4+
-
Sn (aq) + 2e → Sn (aq) 0.15
+
2+
-
Cu (aq) + e → Cu (aq) 0.16
-
ClO4 (aq) + H2O(l) + 2e → ClO3 (aq) + 2OH(aq) 0.17
-
-
-
-
-
AgCl(s) + e → Ag(s) + Cl(aq) 0.22
2+
-
Cu (aq) + 2e → Cu(s) 0.34